Programme
d’assainissement de l’eau
260.AO
Projet d’Intégration
Électrocoagulation d’un affluent de lait
Effectué pendant la session d ‘hiver 2011
Par : Jean-François
Beaulieu
Projet d’intégration
260-615-SL
Groupe :01
Remis à : M.Jean-Claude
Rolland
Copie
revisée du16 mai2011
Session : Hiver 2011
Remerciements :
Un gros merci à Louise Léveillé-Lavallée qui a fait preuve de beaucoup de gentillesse et aussi plus de patience que moi.
Table des Matières
1 Introduction
2 Normes
concernant l’enlèvement
3 Définitions
préliminaires
4 Composition
de l’affluent simulé
5 Résultats
expérimentaux les plus importants
5.1 Observations physiques
5.2 Pourcentage d’enlèvement de la DCO
5.3 Pourcentage d’enlèvement des ortho-phosphates
5.4 Enlèvement de la turbidité et la couleur
5.5 Enlèvement de l’azote
et du phosphore total
5.6 Influence du pH
5.7 Effet d’un polymère
5.8 Enlèvement des MES
5.9 Diminution du poids de l’anode.
5.10 Perte d’efficacité sans nettoyage
5.11 Fer résiduel
6 Applications
possibles
6.1 Insertion dans la chaine de traitement
6.2 Écumoires vs
décantation
6.3 Géométries possibles des bassins et plaques
6.4 Temps de traitement vs ampérage
6.5 Nettoyage et remplacement de l’équipement
6.6 Problèmes éventuels
7 Explication des phénomènes rencontrés, comparaison avec les
sources trouvées
7.1 Différence entre les électrodes de fer et d’aluminium
7.2 Influence du pH
7.2.1 Effet
du pH initial sur l'efficacité de la coagulation
7.2.2 Effet
de l'électrocoagulation sur le pH
7.3 Électrocoagulation et formation de floc
7.4 Ampérage vs temps
8 Design
final et analyse de coûts
9 Conclusion
10 Bibliographie
1
Introduction
On sait que les
municipalités doivent traiter les rejets d'eaux usées pour éviter que celles-ci
ne causent des dommages sérieux à l'environnement. Au Québec, les traitements
classiques sont surtout basés sur l'utilisation d'étangs aérés, d'un traitement
physico-chimique (filtration, coagulation et floculation, décantation et
finalement traitement aux UV) et, dans une moindre mesure, sur l'utilisation de
réacteurs biologiques. Les entreprises qui polluent le plus (papetières,
compagnies minières, usines de transformation des aliments, usines de textiles,
abattoirs, etc..) doivent aussi traiter les eaux de rejet depuis plusieurs
années et les exigences reliées à l'obtention d'un certificat d'autorisation
risquent d'être de plus en plus sévères. Ces compagnies adoptent souvent des
méthodes qui émulent le traitement appliqué dans les usines municipales de
traitement de l'eau usée. Ces traitements ont leurs avantages mais aussi leurs
inconvénients. Des recherches sont constamment faites pour améliorer le
rendement de ces traitements ou trouver des méthodes alternatives.
L'une de ces méthodes
concerne l'utilisation de l'électrocoagulation des eaux usées. Un courant est
acheminé entre deux électrodes et l'anode, qui peut être faite d'aluminium, de
fer, de zinc ou de tout autre métal conducteur se dissocie lentement en ions
qui sont solubilisés dans l'eau. Ces ions vont déstabiliser les colloïdes
existant et faciliter la décantation ou la flottation des polluants. Idéalement
le résultat devrait être une eau propre qu'on peut facilement séparer des
polluants après le traitement.
Plusieurs théories ont
été avancées concernant les phénomènes qui se produisent lors du cassage
d'émulsions ou de la formation de floc et comme ce type d'application est
encore peu rencontré dans l'industrie on ne peut pas dire que tout ce qui se
passe est parfaitement expliqué. Mais une chose est certaine, ce traitement se
rapproche du procédé de coagulation utilisé avec de l'alun ou des sels
ferriques puisque ce sont les mêmes molécules qui vont déstabiliser les
colloïdes. La création de bulles d'hydrogène à la cathode peut également
favoriser l'agitation et le mélange du floc. Reste à savoir si ce procédé est
plus rentable ou s'il offre certains avantages par rapport aux méthodes
classiques.
Plusieurs compagnies
vendent des systèmes d'électrocoagulation de petite taille. Mentionnons
Kaselco, POWELL WATER SYSTEMS, INC,Ecolotron Inc.,
etc..
Les usines de produits
laitier (fromage, yogourts, lait, crème glacée, etc..) qui lavent leurs
équipements rejettent une eau très riche en DBO qu'il faut aussi traiter. Les
eaux usées d'usines de produits laitiers contiennent généralement de deux fois
à six fois plus de composés d'azote que les eaux usées municipales, et leur
demande biologique en oxygène peut être de 10 à 30 fois supérieure à celles-ci[14].
Dans le cadre du cours
Caractérisation des Eaux II nous avons étudié le cas de l'usine de traitement
d'Agropur à Notre-Dame-du-Bon-Conseil qui utilise principalement un système RBS mais
aussi de la coagulation et floculation pour l'enlèvement du phosphore. Dans ce
cas particulier on parle de 2100 m3 par jour à traiter. Il existe cependant de
nombreuses compagnies de petite taille qui doivent aussi traiter leurs eaux. On
comprend que l'utilisation d'un RBS requiert des techniciens qualifiés qui
peuvent réajuster le procédé en fonction de divers paramètres qui fluctuent.
C'est un système complexe qui ne s'applique pas toujours dans le cas de plus
petits débits.
Ce projet vise à étudier
l'efficacité de l'électrocoagulation pour le traitement des rejets d'une usine
de produits laitiers et les possibilités qu'il y a d'insérer un tel traitement
dans une chaîne pré-existante ou comme traitement autonome. Les paramètres qui
seront mesurés sont la concentration en ortho phosphates, en phosphore total,
le pH, le NKT, la DCO, l'azote ammoniacal, la turbidité, la couleur, les MES,
la masse de l'anode dissociée en fonction du courant et de l'efficacité
recherchée.
Le produit utilisé sera
du lait en poudre et de la crème carnation à 25%. Les principales variables
seront l'ampérage, la charge totale en coulombs, le temps, la charge polluante,
le type d'électrode (fer versus aluminium), le pH initial, la concentration
d'électrolyte (sel). Certains paramètres périphériques tels que l'épaisseur de
l'écume, la nature et l'épaisseur du floc, la séparabilité ultérieure seront
également examinés.
2
Normes
concernant l’enlèvement
Pour l’industrie agro-alimentaire, la plupart du
temps les recommandations sur les rejets dépendent non seulement de l’industrie
mais aussi de la quantité globale de rejets (débit) ainsi que la localisation
du point de rejet [35]. On comprend que la capacité d’absorption du milieu
récepteur joue un rôle dans les Objectifs
Environnementaux de Rejets (OER); l’obtention d’un certificat
d’autorisation et le suivi qui en découle varie donc pour chaque cas. Il existe cependant des critères de qualité plus stricts et uniformes concernant les
concentrations existantes, non pas des rejets, mais de l’eau d’une rivière ou
d’un lac.
Phosphore :
Le phosphore rejeté dans les cours d’eau est une cause majeure
d’eutrophisation. Par exemple le critère de qualité pour la protection de la
vie aquatique est de 0.02 mg/L tout au plus pour l’eau d’un lac ou d’une
rivière [36]. Jusqu'à récemment il ne semblait pas exister de norme pour le
phosphore même si une usine peut enlever jusqu'à 75% du phosphore de l’affluent
[37].
Par contre l’enlèvement du phosphore chez Agropur
est obligatoire depuis le 15 mai 2010 et au moins une source dit que [38]:
Dans la plupart
des stations d’épuration, et pour les usines physico-chimiquestraitant de
grands débits d’eau (ex. : Montréal), les normes derejet pour le phosphore sont standardisées
entre 0,50 mg / l et 1.0 mg/l
DBO :
La demande biologique en oxygène est la quantité
d’oxygène qui sera nécessaire pour dégrader les matières organiques biodégradables.
Une DBO trop élevée de rejets industriels peut mener à la destruction de la vie
aquatique, surtout si le débit des rejets est important par rapport au débit
d’une rivière ; les poissons ont besoin d’oxygène pour survivre. La DBO
d’une eau usée industrielle est de l’ordre de 100 à 4000 mg/L. Cependant les objectifs
de rejets varient en fonction du milieu récepteur. Les industries ne sont pas
soumises aux mêmes objectifs, dépendamment de la quantité de rejet quotidien,
mais on peut y voir un lien très fort entre la DBO permise et les MES [35].
DCO :La demande chimique en oxygène est la quantité d’oxygène
qui sera nécessaire pour oxyder toutes les matières organiques. L’impact d’une
DCO sur l’environnement est le même que celui d’une DBO trop élevée.
Azote : L’effet
de l’azote sur l’environnement est multiple. L’azote organique abaisse la
teneur en oxygène de l’eau à moyen terme. L’azote ammoniacal est très toxique
pour les poissons [39]. L’ion ammonium abaisse la teneur en oxygène et est aussi
toxique pour les poissons lorsque le pH est supérieur à 8. Le NO3
favorise l’eutrophisation alors que le NO2 est très toxique pour les
poissons [40]. S’il est vrai qu’il existe des normes assez claires pour les
rejets domestiques la question semble plus compliquée lorsqu’on parle des
rejets industriels ; il y a des directives et un programme d’auto
surveillance dans lequel les municipalités jouent également un rôle [41]. Aux yeux du gouvernement du Québec il semble exister
aussi des valeurs ‘aigus’ d’azote ammoniacal qui dépendent du pH de l’eau
traitée et de la saison. Par exemple pour un pH de 7 ces valeurs sont de
l’ordre de 40 mg/L [42].Cependant la procédure a suivre en cas de violation
semble plutôt compliquée et longue à décrire. Des normes sur le NKT sont
également décrites dans le même document mais en fonction de la charge ajoutée à
la charge traitée par la municipalité [43].
MES :
le diamètre des particules composant les MES est de l’ordre de quelques microns.
Elles peuvent contenir des métaux lourds, aussi est-il préférable d’abaisser le
niveau des MES puisqu’une certaine fraction de celles-ci peut être formée de
produits plus ou moins toxiques. Il y a donc eu par le passé des règlements sur le traitement des MES,
particulièrement pour l’industrie des pâtes et papiers [44]. Cependant il ne
semble pas y avoir de limite quantifiable applicable pour tout le Québec pour
le secteur agro-alimentaire, mais plutôt un ensemble de recommandations [45].
Il en va de même pour les huiles et graisses, qui forment des rejets
agro-alimentaires importants mais que nous n’avons pas pu étudier dans cette
analyse sommaire. Un document semble cependant mentionner une limite de 15 mg/L
mais comme il fait référence au règlement Q2-r8 il s’agit probablement d’eaux
usées domestiques [46]. La réduction de la charge organique semble plus
importante que la réduction des matières fixes non volatiles. Le guide du
promoteur (agro-alimentaire) liste des recommandations et des normes généralement
inférieures à 100 mg/L [47].
Alcalinité :
C’est la mesure de la capacité d’une eau à
neutraliser les acides.Pour certaines industries il semble exister des normes
sur l’alcalinité des rejets dans certaines circonstances, notamment lorsque la
concentration en azote ammoniacal dépasse un certain seuil et qu’on veut
favoriser la nitrification. On demande alors d’avoir au moins 50 à 100 mg/L de
CaCO3.[48]
pH :
Un pH trop basique ou trop acide peut, évidement, être dommageable pour la
faune et la flore aquatique, surtout si la quantité de rejets est importante.
On recommande (par le biais d’un OER) un pH variant de 6 à 9.5 [49].
Turbidité: La
turbidité est causée par la présence de particules en suspension dans l’eau qui
absorbent les photons de lumière et réémette ceux-ci dans toutes les directions;
il y a alors diffusion. Ceci ce produit principalement pour les particules dont
le diamètre est 10 fois moindre que la longueur d’onde de la lumière incidente
(522 ![]() m) [50].Même s’il existe des critères de qualité
pour les rivières et les lacs concernant ce paramètre, il ne semble pas exister
de règle précise de turbidité concernant les rejets industriels.
m) [50].Même s’il existe des critères de qualité
pour les rivières et les lacs concernant ce paramètre, il ne semble pas exister
de règle précise de turbidité concernant les rejets industriels.
Couleur :
La couleur est provoquée par l’absorption sélective de certaines longueurs d’onde
faisant partie du spectre visible. Les molécules qui donnent la couleur sont
normalement plus petites (quelques nm) que celles impliquées dans la turbidité;
ce sont des colloïdes. Par convention le degré de couleur doit être mesuré à pH
7,7. Par contre les particules qui donnent la turbidité faussent la valeur
obtenue aussi doit-on idéalement filtrer l’échantillon au préalable pour
éliminer l’effet causé par la turbidité. On peut alors mesurer la couleur vraie
plutôt que la couleur apparente. Il n’y a aucune norme pour la couleur de l’eau
épurée.
Conductivité :
La conductivité est reliée au résidu sec filtrable par une équation (il est
environ 0.66 fois la conductivité). Il ne semble pas y avoir de critère pour
les rejets industriels dans ce cas.
3
Définitions
préliminaires
Densité de courant: Le courant passant
par l'électrode divisé par la surface de celle-ci
Efficacité du courant (CE): Le ratio
du courant consommé sur le courant minimal pour atteindre un certain objectif.
4
Composition
de l’affluent simulé
Tableau 1 : Comparaison avec les
échantillons Agropur d'avril 2010
|
|
Echantillon typique, 1.5 g de crème+1.5g de lait
en poudre dans 750 mL (affluent) |
Echantillon Agropur, mars 2010 (affluent) |
Echantillon Agropur, mars 2010 (effluent) |
|
Ortho-phosphates, mg/l |
37.6 |
39 |
6 |
|
Azote amoniacal, mg/L |
1.5 |
7.47 |
8.26 |
|
NKT, mg/L |
147.5-485 |
589 |
57.44 |
|
Phosphore total, mg/L |
115 |
111 |
? |
|
Turbidité |
750 |
794 |
14.1 |
|
MES, mg/L |
2440 |
402 |
240 |
|
pH |
7 à
10.5 |
10.88 |
7 |
|
Alcalinité (mg de CaCO3) |
? |
860 |
712 |
|
Conductivité, microS |
495 (sans
sel,pH 10) à 7900+ (3 g de sel) |
3905 |
3456 |
|
DCO, mg/L |
2800-3800 |
2807 |
45.7 |
|
Couleur |
1646 |
1552 |
28.5 |
La majorité des tests ont été fait avec 1.5g de lait
en poudre et 1.5g de crème dans 750 mL d’eau sauf lorsqu’il est spécifié une
concentration différente.
5
Résultats
expérimentaux les plus importants
|
|
|
|
|
|
|
Ci haut : électrode d’aluminium |
Ci-haut : électrode de fer |
La surface de l’électrode d’aluminium plongée dans l’eau est d’environ
2.5 cm x 7 cm x 2 surfaces + 0.4 cm x 7
cm x 2 surfaces=40.6 cm2. La surface
utile de l’électrode d’acier est de 1cm x 8 cm x 2 surfaces = 16 cm2.
5.1 Observations physiques
L’électrocoagulation
permet en 20 ou 30 minutes le cassage des émulsions et la formation de 2 ou 3
phases. Pour un bécher témoin dans lequel il n’y a eu que du sel et du lait, on
n’observe pas de cassage des émulsions. Pour l’anode de fer, avec un volume
initial de 750 mL on a entre les lignes 690 mL et 730 mL une mousse ou un floc
vert, au dessus de 730 mL jusqu’à 800 mL une mousse brun vert. Une partie de la
mousse (celle sous la ligne des 750 mL) contient donc un poids important d’eau.
Le floc formé flotte
principalement à la surface dans le cas d’une anode d’aluminium même s’il y en
a un peu qui décante. Dans le cas d’une anode de fer (d’acier en fait), un floc
peu compacte occupe au moins le tiers du bécher au fond mais on retrouve aussi
une couche de floc sur le dessus.
Il n’y a pas de tassement
notable de la mousse lorsqu’un bocal plus étroit et plus haut est utilisé. Par
exemple pour un bocal rond d’une surface de 86.6 cm2 on a 2 cm de mousse après 15 minutes pour un volume
de 750 mL avec l’anode d’aluminium et, pour un bocal de 25 cm2 contenant 430 mL il y a 4 cm de mousse. Le ratio
volume de mousse/volume d’eau est donc presque constant, ce qui peut avoir de
l’importance si on veut écumer celle-ci à partir d’une ligne de démarcation.
La solution conduit mal
l’électricité sans électrolyte; il faut ajouter au moins 4g/litre de sel
mais dans certains cas jusqu’à 13 g/litre.
Le temps minimal du
traitement semble de 45 minutes pour l’électrode d’aluminium et 30 minutes pour
celle d’acier avec le voltage appliqué (entre 12 et 15 volts, de 0.6 à 2.4
ampères). L’augmentation de l’ampérage ne semble pas donner une relation
linéaire concernant le temps de traitement. Avec la configuration utilisée en
laboratoire il est peu probable que celui-ci puisse se faire en moins de 20
minutes même avec un ampérage élevé.
Le liquide obtenu sous la
couche de mousse est relativement incolore, mais le floc remonte un peu à la
moindre perturbation.
Dans les tests qui
suivent les échantillons ont souvent été prélevés sous la couche de mousse
pendant l’électrocoagulation pour vérifier l’avancement du processus à
différentes étapes. Le fait de les laisser décanter quelques minutes de plus à
l’extérieur de la cellule d’électrocoagulation dans certains cas ne semble pas
avoir d’impact majeur sur les résultats. En effet le floc est souvent amené à
la surface rapidement par les bulles d’hydrogène.
5.2 Pourcentage
d’enlèvement de la DCO
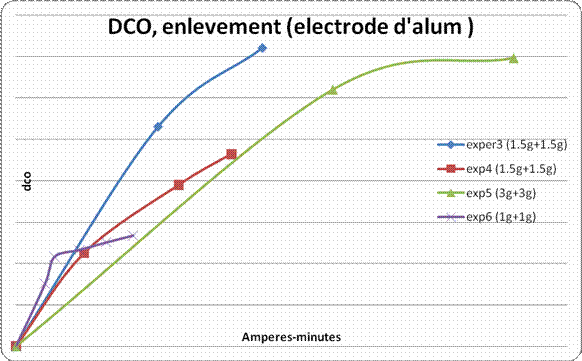
Dans la plupart des
expériences le pourcentage d’enlèvement de la DCO variait entre 50 et 90%, le
plus souvent environ 70%. La différence entre les expériences 3 et 4 est que
pour l’expérience 4 il y a deux fois moins de courant mais pendant
76 minutes au lieu de 45 minutes. Il restait
259 mg/l de DCO à la fin de l’expérience 3, 552 mg/l de DCO à la fin de l’expérience
4, 2120 mg/l de DCO à la fin de l’expérience
5 et 528 mg/l de DCO à la fin de l’expérience 6.
Il n’y a pas de différence majeure avec l’électrode de fer, là aussi un
pourcentage d’enlèvement de 70% est fréquent mais il peut se situer entre 50 et
90%. Le taux d’enlèvement peut dépendre du fait que certains
mini flocs sont présent dans le volume prélevé. Il se peut aussi que la
présence d’un surplus d’ions Cl- perturbe le test de DCO dans
certains cas. Dans certains cas le test de DCO n’a pas été fait avec
l’échantillon de départ et des données de l’expérience précédente ont été
prises; or des tests ultérieurs ont montré que la DCO au départ peut varier de
2800 à 3800 mg/L pour une même quantité de lait en poudre et de crème. La même
expérience qui donnait un taux d’enlèvement de 90% pouvait donner 70% une
semaine plus tard même avec des paramètres apparemment très similaires. Fait
notable : avec un échantillon qui contenait le double de la concentration
initiale habituelle (expérience 5), il y a un plafonnement même si le nombre de
coulombs est augmenté drastiquement. Le procédé est donc beaucoup moins
efficace dans ce cas.
La mousse flottante
obtenue avec l’anode de fer a également été testée. Même si l’échantillon
recueilli en surface contient un pourcentage important d’eau sa DCO est de
l’ordre de 41000 mg/L.
5.3 Pourcentage d’enlèvement des ortho-phosphates
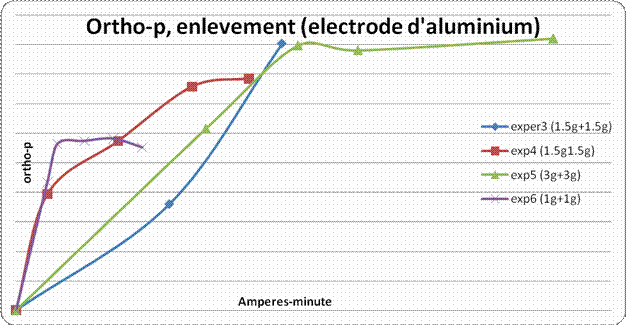
5.4 Enlèvement de la turbidité et la couleur
La turbidité initiale est
d’environ 750 UTN pour l’échantillon standard (1.5g de lait en poudre+1.5g de
crème 25%). Elle descend à 30 ou 35 UTN dans le meilleur des cas. Le taux
d’enlèvement est donc généralement supérieur à 95%. Pour la couleur le taux
d’enlèvement varie de 96 à 99% sauf pour l’échantillon surchargé, comme
d’habitude.
5.5 Enlèvement de l’azote et du phosphore total
Il y a eu beaucoup moins
d’expériences pour vérifier le phosphore total et le NKT, néanmoins il semble
que le pourcentage d’enlèvement de l’azote dans l’effluent soit de 98 ou 99%
(NKT) et de 97 à 98% pour le phosphore total. L’azote ammoniacal, lui, fluctue
tout au long de l’expérience mais il n’y a pas vraiment d’enlèvement.
5.6 Influence du pH
La plupart des tests ont
été faits avec un pH de départ de 7 mais trois tests avec l’anode de fer ont
été fait avec un pH de départ basique, soit environ 10.3. Il semble que
l’enlèvement de la DCO soit jusqu’à 10% moins efficace pour un pH initial élevé
pour un nombre pratiquement équivalent de coulombs dans un cas, pour les deux
autres tests les chiffres sont comparables. Il en va de même pour l’enlèvement
des ortho phosphates. Le ratio nombre de coulombs générés sur la perte en poids
de l’anode est, par contre, le double de ce qu’il est
à pH neutre. Comme l’ampérage est du même ordre que pour les autres tests, ceci
veut dire que le temps alloué pour l’électrocoagulation et l’obtention
d’une eau peu colorée est plus important.
Avec l’anode d’aluminium il n’y a pas de
variation sensible du pH. Avec l’anode de fer le pH passe de 7 à 9.5 ou 11
selon le cas. Pour un pH initial de 10.3 le pH est même monté à plus de 12 avec
l’anode de fer. Un pH élevé semble aussi
favoriser la flottation et défavoriser la décantation. Dans un cas le bécher
(pH 11.5) a été transvidé en partie dans un autre bécher et de l’acide a été
ajouté au deuxième pour ramener le pH à 7. La décantation se faisait beaucoup
mieux dans le deuxième bécher que dans le premier. A pH 9.6 la décantation se
fait après plusieurs légers brassages en surface mais il semble que celle-ci
soit plus lente qu’à pH neutre. Il est possible que l’agitation suite à l’ajout
d’acide ait joué un rôle dans l’enlèvement des bulles, néanmoins il est
probable que des expériences plus méthodiques tentant de cerner uniquement le
taux de décantation en fonction du pH confirment cette
tendance puisque celle-ci a été observée sommairement à trois reprises.
5.7 Effet d’un polymère
Du Magnafloc a été ajouté au bécher après l’enlèvement de l’anode de fer pour une concentration finale d’environ 1 mg/L. La décantation est alors accélérée et le floc dans le fond est plus compact.
5.8 Enlèvement des MES
Le pourcentage enlèvement de la turbidité suggère qu’il y a aussi un
enlèvement important des MES avec l’anode de fer. Un seul test de MES par
ébullition/déshydratation a cependant
été fait. Le taux de MES initial (2,44g/litre) est tellement important par
rapport à l’échantillon Agropur de 2010 (402 mg/L) et au poids ajouté (1.5g de
poudre et 1.5g de crème dans 750 mL) qu’il est probable qu’une erreur
expérimentale a été commise et que l’échantillon a été prélevé après l’ajout de
sel (3 grammes). Néanmoins les 86 mg/L restant indiquent que l’abattement est
considérable par rapport à l’échantillon Agropurde 2010 (240 mg/L pour
l’effluent vs 402 mg/L pour l’affluent). Il y a visiblement eu une réaction
avec les ions Na+ et Cl- en cours de route puisque ceux-ci ne se retrouvent même pas sur le
papier filtre (pour 40 mL d’eau épurée). Il aurait été intéressant de ramener
le pH de l’eau à 7 après l’expérience et de vérifier sa
conductivité ensuite.
5.9 Diminution du poids de l’anode
Le tableau suivant illustre les résultats de plusieurs de mes expériences.
Tableau 2 : Perte de poids vs courant,
aluminium et fer
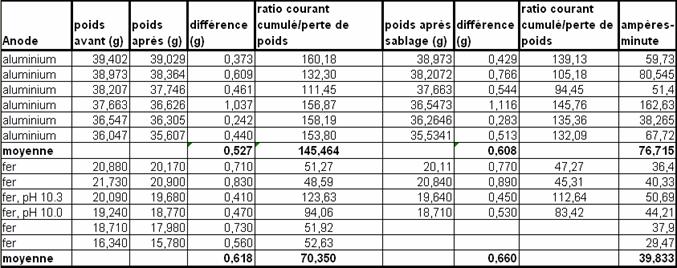
Les
ampères-minute ont été choisis
plutôt que les coulombs pour garder le même standard qu’ailleurs dans ce
document. La diminution du poids de l’anode ne dépend pas du temps de
traitement mais du nombre de coulombs sauf lorsque le pH n’est pas neutre. Il
est possible que le ratio de 111,45 trouvé à la ligne 3 soit dû à une erreur
expérimentale.
5.10 Perte d’efficacité sans nettoyage
Il avait déjà été noté lors de la toute première expérience avec
une électrode d’aluminium que le courant baissait de façon significative sauf
si du sel était rajouté. La couche d’oxyde et les dépôts sur l’anode nuisent au
libre passage du courant. Un test a cependant été effectué avec l’anode de fer
pour évaluer l’impact de l’absence de nettoyage. Entre chaque période de 40
minutes la solution a été jetée mais un échantillon a été gardé pour prendre la
DCO. Puis la même anode a été réutilisée avec une nouvelle solution, mais sans
nettoyage. L’opération a été faite quatre fois jusqu’à la dissolution complète
d’une partie de l’anode qui était trop grugée. Le courant moyen était de 0,8
ampère dans le premier cas, 0,97 dans le deuxième cas, 0,83 dans le troisième et
0,55 ampère dans le quatrième cas. Puis il y a eu une baisse soudaine suite à
la dissolution d’une partie importante de l’anode, la lame était tout
simplement trop mince pour tenir le coup. Le courant varie lorsque les
électrodes sont rapprochées ou éloignées, ce qui est inévitable lorsqu’il y a
changement d’eau dans le bocal. On peut en déduire que la couche d’oxyde de fer
est beaucoup plus poreuse que la couche d’oxyde d’aluminium, donc le nettoyage
d’une anode de fer peut se faire à intervalles moins fréquents.
Pour donner une estimation, il a fallu 102,6 ampères-minute (6155
coulombs) au total pour que le courant diminue soudainement lors de la
troisième expérience (fin de la troisième expérience sans nettoyage). Ceci
correspond à environ 2,4g de fer dissous pour une surface de 16 cm2ou
0,15g par cm2. En fixant une densité de courant optimale et en connaissant
la surface des électrodes utilisées dans un cas réel, il sera ainsi possible
plus tard d’évaluer la fréquence nécessaire des périodes de nettoyage.
5.11 Fer résiduel
Le produit final a été testé avec la méthode Hach pour vérifier la
présence de fer total en solution. Celui-ci était présent en concentrations
importantes à la fin du traitement mais l’ajout d’un polymère et quelques
minutes d’attente ont suffi pour que les cations restants soient neutralisés
par des ions hydroxyde et que le floc décante. A la fin la concentration de fer
était minime.
6
Applications
possibles
6.1
Insertion dans la
chaine de traitement
L'électrocoagulation peut
être utilisée comme seul procédé dans certains cas, notamment s'il s'agit d'eau
usée puisque ce procédé se substitue au traitement physico-chimique et
biologique. Cependant si l'abattement en DBO/DCO n'est pas suffisant pour
rencontrer les critères de rejet il faut utiliser une autre option pour aller
chercher d'avantage de DCO. Des solutions sont ébauchées dans la section 6.6,
elles concernent des méthodes physico-chimiques qui seraient ajoutées à la fin
du traitement. D'un autre côté on peut aussi utiliser l'électrocoagulation
uniquement pour obtenir un abattement en phosphore, tout juste après un
traitement biologique.
Le prototype utilisé
indique que le temps de traitement doit être d'au moins une demi-heure,
idéalement 40 minutes avec une anode de fer ou d'acier. Ceci a un impact sur le
volume du bassin utilisé. Par exemple pour une usine rejetant 2,000 m3 d'eau par jour il faudrait prévoir un volume d'au
moins 50 m3 pour 24h d’opération. En
comptant le nettoyage fréquent des électrodes et le nettoyage occasionnel des bassins,
un volume de 75 m3 pourrait même être nécessaire. Le
retrofitting avec des installations est possible dans certains cas, bien
entendu il faut un bassin fait d'un matériau non conducteur. A titre de
comparaison la cellule d'électrocoagulation "Big Boy" de la compagnie
Kaselco (0.762m x 0.635m x 1.83 m ou 0.885 m3) peut traiter, d'après le
manufacturier, 25 gpm soit 136.5 m3
par jour. Dans leur cas on a donc un volume théorique nécessaire d'au moins 13
m3 ou 15 cellules pour traiter 2,000 m3 répartis uniformément sur 24 heures.
Cependant on peut parier
que le manufacturier donne le débit sans tenir compte des périodes d'entretien
et qu'il n'a pas utilisé une eau très
chargée pour établir ce débit. En effet ce débit «accrocheur», affiché à côté
de la cellule ne fait pas mention d'une application spécifique, hors la page
principale de cette compagnie donne une bonne trentaine d'applications
possibles, enlèvement des métaux, émulsions, phosphates, MES, de l'huile, de la
couleur, etc... Néanmoins il se pourrait que la densité de courant soit la
cause de cette différence comme on le verra plus loin.
Les coûts en maintenance
pour un "kit" préfabriqué ne sont pas connus, mais pour un système
maison on doit compter le remplacement des électrodes et surtout leur
nettoyage, idéalement aux heures dans le cas de l’aluminium puisque
l'efficacité décroit de façon spectaculaire lorsqu'une couche d'oxyde se forme
sur l'anode. Bien entendu un tel nettoyage ne peut être manuel.
S'il y a ajout de
polymère et que le système n'est pas de type "DAF" mais qu'on a un
système utilisant la décantation ou encore un système hybride utilisant les
deux à la fois, il faut prévoir un racloir contrôlé automatiquement afin de
nettoyer périodiquement le fond du bassin. De surcroit il faut alors une pompe
doseuse. On peut imaginer un système où, à la fin du traitement, les plaques
qui servent d'électrodes sont soulevées, plongées dans un bassin de nettoyage
pendant que le polymère est injecté et qu'un support est amené automatiquement
au-dessus du bassin pour permettre l'agitation avec des hélices. Avec un
système de type "DAF" uniquement par contre il serait préférable
d'injecter de l'air comprimé pendant l'électrocoagulation puisqu'une partie du
floc a tendance à décanter vers le fond. Les microbulles d'hydrogène qui se
fixent au floc font flotter seulement une partie de celui-ci.
6.2 Écumoires vs décantation
Dans tous les tests,
autant avec l'anode d'aluminium que celle fer, on a un mélange de mousse et de
grumeaux qui flottent et de floc qui décante. Dans le cas d'une électrode
d'aluminium il y a une mousse abondante et peu de floc au fond, sauf lorsqu'il
y a eu d'ajout de polymère. Dans le cas d'une anode d'acier on a le contraire.
On a donc trois choix possibles; l'enlèvement de l'écume, la décantation forcée
(à l'aide d'un polymère) et un système hybride.
Si le choix s'arrête sur
un système DAF, on doit minimiser la décantation et ceci peut se faire que par
l'injection en continu d'air dissous près du fond. Un système d'injection d'air
peut être assez coûteux et énergivore. Néanmoins la récolte de l'écume par le
biais de goulottes est un système qui est, mécaniquement parlant, relativement
simple. Cependant il faut s'attendre à traiter l'écume ultérieurement. Les
déchets solides peuvent être transportés et enfouis mais un séchage de l'eau
résiduelle doit être prévu. Nous n'avons pas vu dans le cadre de nos cours ce
qu'il advient de l'écume dans un système DAF mais une recherche rapide montre
que le traitement de celle-ci implique parfois l'ajout de nouveaux produits
chimiques pour accélérer la séparation dans un réservoir à part même si un
processus d'adsorption sur un média quelconque est parfois mentionné. Le
séchage forcé de l'eau n'est pas mentionné; celui-ci est probablement trop
énergivore. Il semble que pour certains types de rejets l'ajout d'un floculant
après la phase de coagulation favorise la flottation.
Pour une anode de fer,
comme la majorité du floc semble décanter, il peut sembler plus logique de
récolter le floc à l'aide d'un racloir. Néanmoins le floc est tellement peu
dense qu'il semble exclu de ne pas utiliser de polymère dans ce cas. Les tests
au laboratoire montrent que le floc, qui occupe initialement environ le tiers
de la hauteur du bocal, peut n'occuper que le cinquième de celui-ci après
quelques minutes si on ajoute 1 mg/L de polymère Magnafloc. Cependant on peut
s'attendre à un floc plus compact encore avec le temps. Par contre même après
avoir agité légèrement le floc résiduel en surface, une partie de celui-ci refuse
de décanter, surtout à pH basique. Il est sûrement possible par essais erreurs
de trouver les paramètres de dosage de polymère, de pH et de temps
d'électrocoagulation qui permettent de reproduire les conditions qui ont permi
l'obtention d'une décantation parfaite dans un cas seulement (en mars), mais vu
le nombre d'expériences qui ont laissé une couche mince de floc en surface il
faut aussi envisager un scénario où ce problème se reproduirait souvent dans la
vie courante.
Un système hybride
implique d'avantage d'équipement mais il peut aussi minimiser les problèmes de
maintenance si l'obtention d'un floc décantable à 100% s'avère trop difficile.
Le bassin principal ne comprendrait pas de système d'injection d'air mais le
bassin secondaire qui récolte un mélange de mousse et d'eau (via les goulottes)
serait équipé d'un tel système. Comme ce bassin est beaucoup moins profond la
pression requise pour l'injection d'air est moindre. L'eau du fond de celui-ci
peut être recirculée vers le bassin principal et déversée à 20 ou 30 cm sous la
surface de celui-ci alors que le floc récolté subit un
traitement ultérieur. Ce système impliquerait donc une quantité de mousse très
réduite par rapport à un système DAF conventionnel.
Une question qui se pose
est celle de l'injection du polymère. Dans certains cas l'ajout de polymère
peut aider à la flottation, mais les tests au laboratoire sont contradictoires
concernant cet aspect. La jonction de deux flocs peut donner une meilleure ou
une moins bonne flottabilité, dépendamment de la flottabilité individuelle de
ceux-ci. Un floc légèrement plus dense que l'eau qui se combine à un floc moins
dense va neutraliser celui-ci; un floc qui remonte rapidement à la surface et
qui se combine à un floc plus petit mais d'une densité égale à l'eau va aider
celui-ci à faire surface. Il faudrait faire des tests sur un prototype plus
élaboré pour vérifier si l'injection de polymère dans le bassin secondaire est
préférable ou pas.
Il reste un aspect
important à traiter, soit l'utilisation du mode "batch" ou d'un mode
en continu. Le premier simplifie les problèmes associés à la maintenance de
l'équipement, le deuxième permet de contrôler mieux l'homogénéité du mélange et
de réduire le volume requis (pas de temps morts pour le vidage et remplissage).
6.3 Géométries possibles des bassins et plaques
On peut envisager
plusieurs configurations en mode batch ou en mode continu. Guohua Chen [23]
propose quelques designs théoriques où les électrodes sont concentriques,
plates, verticales, horizontales, etc... Puisque la passivation des électrodes
est un problème qui s'est posé même lors des tests en laboratoire il est
peut-être moins risqué de chercher un arrangement simple même si, en théorie,
une autre configuration plus sophistiquée assure une meilleure densité de
courant. Les deux configurations suivantes donnent un exemple:
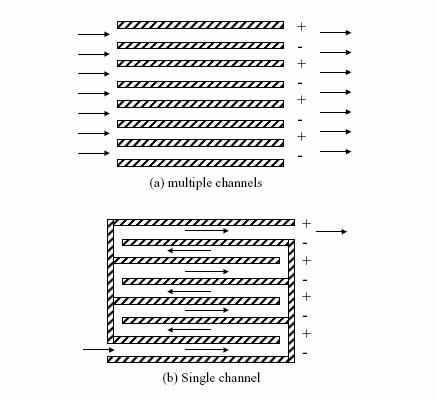
Figures
1a et 1b : Deux configurations possibles. Source : [23]
La
figure (a) permet le traitement de débits important mais on peut se douter que
certains problèmes se poseront. L'un deux concerne la déposition de floc sur
les électrode, l'autre le fait qu'on a le choix entre un bassin démesurément
long pour assurer un temps de contact suffisant, un ampérage énorme (ce qui
n'est pas optimum) ou une hauteur telle que la vitesse horizontale entre deux
plaques serait très faible. La figure (b) permet de récolter le rejet dans une
zone où les bulles d'hydrogène peuvent dégazer, donc il est possible d'injecter
le polymère tout de suite après. La vitesse de l'eau entre chaque plaque limite
la déposition de floc. Cependant ce design amènerait d'autres problèmes,
notamment l'adjonction d'un deuxième réservoir pour permettre la décantation et
le sucroit possible de maintenance. On peut mécaniquement soulever les deux
fourches imbriquées et tremper celles-ci dans un bain d'acide pour enlever les
dépôts ou la couche d'oxydation mais il faut prévoir un support adéquat pour
l'assemblage des plaques. En effet il est probablement plus rentable d'acheter
des plaques de métal et de graphite simples et d'insérer celles-ci dans un
support que de demander à un manufacturier de livrer le tout emboité. Le
sablage mécanique des plaques, s'il est nécessaire, serait très difficile entre
chaque opération.
Le
schéma montré sur le site du CNIDEP[25] semble
beaucoup plus attrayant:
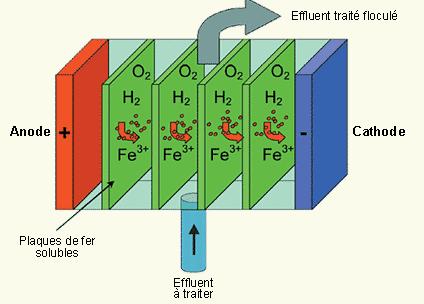
Figures
2, système CNIDEP
Ce
système est simple, la déposition sur les électrodes est minimisée vu la
position verticale de celles-ci, il ne manque qu'un espace en bas pour le
racloir et le floc sédimenté. Par contre on peut se poser des questions sur les
chemins hydrauliques préférentiels d'un tel système en mode continu. En mode
batch il serait toujours possible de soulever mécaniquement les plaques de fer
et nettoyer celles-ci pendant que le bassin se vide ou que du polymère est
injecté. Bien entendu un système de récupération de l'écume par goulottes et de
la concentration de celle-ci doit aussi être prévu. En mode continu, vu le courant ascendant et
les bulles d’hydrogène le système serait largement de type DAF mais il n’est
pas exclu que du floc lourd se retrouve
sous les plaques, surtout s’il existe des zones mortes loin du ou des tuyau(x)
d’arrivée. Donc un racloir pourrait être nécessaire malgré tout. L’utilisation
d’un polymère est probablement contre indiqué en mode
continu.
La
géométrie interne du système commercial Kaselco n'est pas connue mais vu la
taille de la cellule et les « 25 GPM » mentionnés il s'agit presque
certainement d'un système s'apparantant à celui de la figure 1-a de la page précédente.
Comment les problèmes d'entretien et de nettoyage ont été résolus pour des
effluents très chargés, en autant que ces problèmes soient résolus, je
l'ignore.
Le
ratio surface de plaques/volume doit également être regardé. La surface des
électrodes influence la densité de courant, le dosage des cations et de bulles
et le chemin emprunté par celles-ci.
Peter Holt[16] donne dans un tableau les ratios
optimums obtenus par différents chercheurs: Osipenko et Pogorelyi 18.8 m2/m3,
Novikova 42.5 m2/m3,Amosov 30.8 m2/m3.
Holt rapporte que d'après une autre source que lorsque le ratio S/V s'accroit
la densité optimale de courant décroit. Dans notre cas le temps de rétention
voulu et le débit existant va être le dernier paramètre pour fixer le volume du
bassin principal, donc la surface des électrodes. Idéalement on devrait
s'attendre à un ratio S/V de 30 m2/m3.
Qu’on
soit en mode batch ou en mode continu il est préférable d’avoir de plus petites
cellules qu’une seule grosse cellule. Par exemple si on considère une DDP de
quelques volts entre chacune des plaques et une distance de quelques
centimètres entre celles-ci on atteint rapidement une DDP totale de plusieurs
milliers de volts pour un long bassin allongé.
6.4 Temps de traitement vs ampérage
La densité de courant
définit la quantité de métal dissous par unité de temps ainsi que la production
de bulles. La majorité des expériences faites donnent une densité de courant
entre 10 et 150 A/m2 [16].
Rappelons qu’avec la surface utile des anodes utilisées dans mes tests (40.6 cm2 pour
l’aluminium, 16 cm2 pour
l’acier) et un courant variant de 0.6 à 2.4 ampères on obtient entre 147 et 591
A/m2 pour l’aluminium et de 375 à 1500 A/m2 pour le fer. La source de tension utilisée
s’apparentait à celle des expériences de la littérature, mais mes anodes de
fortune étaient beaucoup plus petites.L’impact possible de cet écart monstrueux
sera évalué dans la section 7.4.
Holt mentionne qu'un
courant de haute densité est préférable dans un système de flottation ou des
bassins larges alors qu'un courant de faible densité est préférable pour un
système conventionnel intégrant des filtres à sable ou à charbon. Holt base
probablement son affirmation en tenant compte de la génération de nombreuses
bulles d'hydrogène de petite taille avec un courant élevé. Ses motifs pour un
courant de basse densité sont non pertinents dans le cas qui nous préoccupe
puisqu'on ne peut utiliser un filtre à sable dans un système d'eaux usées (il
faudrait laver celui-ci et rejeter les polluants à l'égoût).
On peut relier toutes les
anodes entre elles par un contact relié à la borne positive de la batterie;
c'est le mode en parallèle; On peut aussi relier par un contact deux électrodes
secondaires qui ne sont pas en contact direct avec la batterie; c'est le mode mono polaire. En
laissant les plaques libres dans la solution un pôle opposé se formera aux deux
surfaces de chacune d'entre elles; c'est le mode bipolaire tel qu’illustré ici.
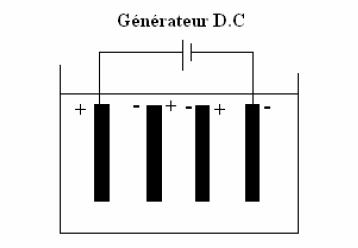
Mounir Bennajah mentionne que [20]:
Selon Prétorius et coll. (1991) et Rajeswhar
et Ibanez (1997), il est économiquement plus rentable de transformer un courant
alternatif en courant continu de faible intensité et forte tension, que de le
transformer en courant continu de forte intensité et de faible tension. Pour
ces raisons, Golder et coll. (2006) et Ayhan et coll. (2007), estiment que
l’utilisation du mode en série est plus judicieux et conseillent, en outre, le
fonctionnement bipolaire car celui-ci ne nécessite le branchement que de deux
connexions (quel que soit le nombre d’électrodes), il en résulte donc une
moindre consommation électrique.
6.5 Nettoyage et remplacement de l’équipement
Comme on l'a vu dans les
résultats expérimentaux il faut peu de temps avant que l'efficacité ne diminue
suite aux dépots qui se font sur l'anode et la cathode, surtout pour une
électrode d’aluminium. Un nettoyage fréquent des électrodes entraîne un coût
suite à l'arrêt temporaire des opérations. L'absence de nettoyage par contre
implique une consommation d'énergie de plus en plus grande puisqu’on veut
favoriser la coagulation par dissolution de l’anode avec un minimum de courant.
Si on dispose d'informations solides sur
le coût excédentaire d'une fréquence de nettoyages élevée (volume de bassin
plus grand pour compenser le débit interrompu, usure plus grande des éléments
assurant le nettoyage, quantité plus importante d'acide s'il y a lieu) alors on
peut certainement établir un point mort en comparant les coûts de chaque
option.
La couche d'oxydation du
fer est plus poreuse que celle de l'aluminium, pourtant l'absence de nettoyages
nuit quand même à l'efficacité. Non seulement doit-on éliminer la couche
d'oxydation mais encore faut-il détartrer la cathode. Des ions calcium et
d'hydrogénocarbonate s'y déposent. Bennajah suggère de réaliser une inversion
périodique de la polarité pour limiter le problème.[20]
Après avoir étudié
plusieurs méthodes pour faire face au problème posé par la passivation des
électrodes, Nikolaev retient le nettoyage mécanique périodique de celles-ci
comme le moyen le plus efficace. Les autres méthodes sont le nettoyage
chimique, l'utilisation d'agents inhibiteurs et le changement de polarité [16].
Le nettoyage par sablage mécanique n'est certainement pas trivial à implanter.
Le trempage dans une solution de HCL a déjà été tenté et donne quant même des
résultats potables [19]. Ceci implique que lors de l'évaluation des coûts on ne
pourra pas prendre en considération le rendement "enlèvement des
polluants" sur la puissance délivrée à moins de multiplier par un facteur
de sécurité. En effet les données de la littérature et mes données
expérimentales concernent souvent une anode et une cathode nettoyées au départ.
La dissolution complète
de l'anode dans le bassin peut être envisagée et ne pose pas de problèmes
majeurs en mode batch. Lorsque la feuille devient trop mince on devra
probablement avoir deux traitements pour la même eau afin de compenser pour la
réduction de densité de courant pendant le premier traitement mais la question
de la disposition des plaques rouillées ne se posera pas. En mode continu par
contre il faut prévoir un arrêt des opérations et le remplacement des plaques
trop minces. Comme il est impensable de ne pas nettoyer au moins de temps à
autre les plaques une inspection visuelle peut être faite à ce moment. Malheureusement
il est à prévoir que les plaques ne seront pas toutes usées à la même vitesse
et que l’épaisseur d’une plaque variera d’un point à l’autre sur celle-ci avec
le temps. Le remplacement individuel des plaques trop minces permet une
économie sur le coût des matériaux, par contre le remplacement en vrac à partir
d’une matrice montée à l’avance permet une économie de main d’œuvre. Cette
dernière option semble plus attrayante. S’il y a trop de pertes au niveau des
matériaux, soit un degré d’homogénéité trop faible concernant la corrosion des
différentes plaques, il faudra probablement s’attaquer aux causes. Les dépôts
de tartre en certains endroits peuvent entraver la dissolution, une résistance
plus grande au passage du courant entre deux plaques aussi. Les effets de bord,
soit l’impact qu’a la proximité d’une arête sur le courant hydraulique sont à
surveiller aussi.
6.6 Problèmes éventuels
Lactose résiduel:
Le pourcentage
d'enlèvement de la DCO (%) est relativement faible par rapport au pourcentage
d'enlèvement des autres substances comme le phosphore, l'azote, la couleur et
les MES. Comme l'eau de l'effluent est très chargée en DBO ceci risque de poser
un problème si on veut rencontrer les objectifs de rejets. Les données
expérimentales peuvent d'ailleurs être comparées à celles de la littérature
concernant l'enlèvement de la DBO/DCO pour des effluents laitier (61% pour
Tchamango [1], 50% pour Arslan-Alaton[15], de 30 a 75%
pour Ni’am[18],
67-69% pour MansoorJehangir[21]) .
Tchamango suggère que le
lactose serait le produit restant. Ceci est confirmé par les expériences de
Moreno [ réf:2, tableau IV] qui montrent que pour des solutions qui ne
contiennent que du lactose, de l'acide acétique ou du glucose, le pourcentage
de recouvrement par coagulation est extrêmement faible.
Le lactose est décomposé
par des bactéries et des enzymes en glucose et en galactose avant de subir
d'autres transformations [3]:.
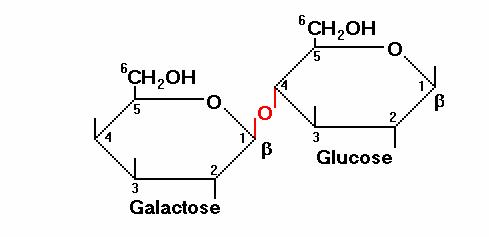
Dans le cas présent il
est clair que ces molécules ne s'ionisent pas négativement dans l'eau et que,
contrairement aux autres colloïdes, leur interaction avec les coagulants
cationiques (Al(OH)3,
Fe(OH)3 ) est nulle ou minime. Le
meilleur moyen d'éliminer le lactose est de laisser les bactéries faire leur
travail, mais ceci amène certains problèmes dans dans notre cas:
1) L'enlèvement d'une
partie de la DBO, du phosphore et de l'amoniac a pu priver certaines bactéries
d'éléments nutritifs nécessaires à la décomposition du lactose. Rajouter ces
nutriments après les avoir enlevé serait absurde dans le cas présent.
2) Même si les bactéries
peuvent encore décomposer le lactose à l'intérieur d'un délai raisonnable dans
un milieu appauvri, ceci ne résout pas le problème du floc formé, du degré ou
de la vitesse de sédimentation et de l'expertise technique et des équipements
nécessaire à l'entretien d'une réaction aérobie ou anaérobie pour éliminer le
surplus de lactose. Un des avantages majeurs entrevus au début de ce travail
était la possibilité de se défaire d'un RBS et du coût considérable associé à
cette technique, surtout pour une petite installation.
Si les rejets recontrent
malgré tout les objectifs visés, il n'y a pas de
problème. Cependant comme le lait contient pratiquement 5% de lactose[4], il faut s'attendre à ce que la DCO ne respecte pas
ces objectifs. Dans le cas d'Agropur par exemple la DCO de l’effluent pour
l’échantillon 2010 est de 45 mg/L. Ceci suggère que les 250 à 500 mg/L après
électrocoagulation pour une charge initiale semblable sont encore trop élevés.
Certaines options demeurent
tout de même. Le fer réussit parfaitement à coaguler
les ions PO4- et le phosphore en
général, donc ce traitement pourrait être inséré à la fin de la chaine de
traitement où on trouve actuellement un procédé classique de
coagulation-floculation pour l'enlèvement du phosphore.
Si on veut malgré tout
trouver une solution qui ne nécessite pas de traitement biologique, d'autres
options peuvent aussi être explorées.
Plusieurs moyens
d'éliminer le lactose résiduel ont été recherchés, mais le problème est plutôt
complexe. La filtration par membrane (ultrafiltration) est communément utilisée
pour séparer le lactose des autres constituants lors de la mise en marché de
certains produits laitiers. Cependant on cherche à obtenir un produit sec ne
contenant pas de lactose et ce dernier passe du mauvais côté de la membrane,
i.e. avec l'eau. La nanofiltration donnerait un débit tellement ridicule et
couterait tellement cher qu'il vaut mieux ne pas y penser. [7]
Le lactose a une valeur
commerciale lorsqu'il est récupéré, mais le processus est aussi couteux,
surtout si l'échantillon de base est dilué [10]. Dans le cas présent il n'est
pas nécessaire de récupérer le lactose, le détruire serait suffisant. Par
contre même si les UV peuvent inhibiter le travail de certaines bactéries lors
de la synthèse de sous produits du lactose, il ne semble pas qu'on puisse
détruire celui-ci par irradiation [8]
Une méthode par
précipitation a été proposée par Soon-Young Kwon et Richard Bernahrd,
l'utilisation de chloride de magnésium et d'hydroxide de sodium à température
ambiante (et pH neutre ou basique) pour des échantillons ne comportant
pratiquement que du lactose (5% de poids par unité de volume, soit pratiquement
ce qu'on aurait dans le lait). Les résultats sont assez spectaculaires puisque
le ratio de recouvrement approche les 98% pour un ratio molaire prédéfini. Le
processus est cependant relativement lent (30 minutes au moins), il nécessite
de l'agitation et surtout ces chercheurs ont utilisé une centrifugeuse pendant
une dizaine de minutes pour favoriser l'extraction du précipité.[9]
D'autres alternatives,
notamment la précipitation à l'aide d'hydroxyde de calcium (Ca(OH)2) parfois combiné à du NH4Cl sont parfois mentionnées dans la littérature
mais ces références sont souvent payantes et faute de budget il m'a été
impossible de vérifier si la réaction demandait un apport en énergie, ce qui
rendrait le procédé moins attrayant. [12]
Vu l'efficacité reconnue
du peroxyde d'hydrogène pour oxyder la matière organique, il était tentant de
faire une dernière expérience en dosant de petites quantités de celui-ci
(ratios de 1 :500, 1 :200, 1 :100, 1 :50) avec l’effluent
contenant surtout celui-ci. Malheureusement il a été découvert au laboratoire
et vérifié lors d’une recherche ultérieure [27] que le peroxyde interfère avec
les produits chimiques utilisés pour la mesure de la DCO ce qui fausse les
résultats. Le produit est tellement cher qu’il est même impensable d’utiliser
un ratio 1 :500. De toute façon certaines autres sources (i.e. pasteurisation
possible du fromage avec du peroxyde, etc.…) impliquent probablement que le
peroxyde serait peu indiqué. Un réactif de Fenton est aussi difficilement
envisageable puisqu’on devrait partir d’un pH de 11, soit après la
coagulation-floculation avec l’électrode de fer, pour ajouter de l’acide et
aboutir à un pH de 2 ou 3, utiliser ce réactif,
puis re-neutraliser le pH à 7 et évacuer l’eau vers l’égout. D’autres
sources concernant la dégradation en milieu alcalin ont été également trouvées
[28] mais je n’ai pu vérifier en détails si cette méthode est applicable ici vu
la complexité de l’article et le temps restant.
Il peut exister d'autres
moyens, mais ceux-ci ne peuvent qu'être formulées sous forme d'hypothèses,
faute de tests et d'expertise.
1) Une des réactions
souvent associée à la transformation du lactose en solution est la réaction de
Maillard. En gros il y a substitution avec un groupe amine (provenant de
protéines surtout) pour former un groupe OH.
Il y a une quantité
considérable de sous produits formés mais le but ici serait d'obtenir un
colloide qui puisse s'ioniser plus facilement afin de faciliter un floc avec un
coagulant anionique ou cationique. Bien entendu la nature des produits
chimiques à utiliser (ou du catalyseur) n'est pas connue, donc il ne s'agit pas
d'une solution à l'heure actuelle. Chose certaine, il faudrait encore que
certains critères économiques soient respectés, donc un ensemble de réactions à
haute température n'est pas souhaitable. Dans le cas de la réaction de Maillard
une haute température et une forte alcalinité accélèrent la réaction [6].
Même si cet aspect a été mentionné dans la section
Nettoyage de l'équipement, il convient de souligner dans cette section
le fait qu'une solution élégante n'a pas été trouvée. Il faut s'attendre à ce
que la densité de courant "optimale" qui existe dans de belles
petites expériences en laboratoire soit très éloignée de ce qui serait
rencontré dans la vraie vie.
7
Explication des phénomènes
rencontrés, comparaison avec les sources trouvées
7.1 Différence entre les électrodes de fer et d’aluminium
Le lait est en fait une
émulsion qui contient des graisses dispersées dans l'eau; l'agent émulsifiant
qui stabilise le tout est la caséine, une protéine contenat des groupes
phosphate. Les groupes anioniques de celle-ci empêchent la coagulation des
goutellettes d'huile par répulsion électrostatique. L'électrocoagulation permet
d'oxyder l'anode sacrificielle et les cations libérés peuvent neutraliser la
charge de surface des molécules de surfactant (caséine)[19].
Les particules colloidales d'huile peuvent commencer à s'agglomérer; celles-ci
monteront à la surface. Cependant la coagulation avec des molécules insolubles Fe(OH)3(s) peut
aussi entrainer celles-ci vers le fond.
Chen mentionne que
l'aluminium est surtout utilisé pour l'eau potable alors que le fer l'est pour
l'eau usée [23, p.20]. Ceci expliquerait peut-être une contradiction flagrande
entre mes données experimentales et celles d'AyhanSengil. I. AyhanSengil est le seul auteur qui prétend avoir obtenu
un taux d'enlevèment de 98% pour la DCO; tous les autres donnent un taux
d'enlèvement variant de 50 à 75%[19]. Mais AyhanSengil utilise un échantillon
tellement chargé (plus de 18000 mg/L de DCO) que les 360 mg/L restant
s'approchent de la DCO résiduelle obtenue au CEGEP à partir d'une DCO initiale
de 2500 ou 3000 mg/L. Il y avait probablement peu de lactose dans son
échantillon. Quoi qu'il en soit les deux expériences où j'obtenais un taux
d'enlèvement médiocre et un plafonnement rapide impliquaient un échantillon de
départ dont la DCO était de près de 6000 mg/L et une anode d'aluminum.
Ayhan utilise une anode de fer. Les expériences faites sur des échantillons
d'une DCO initiale de 2800 mg/L donnent des résultats beaucoup plus
acceptables, même avec l'aluminium.
Le fait que l'électrode
d'aluminium donne une mousse qui flotte d’avantage peut être relié au poids de
l'atome mais il est plus probable que le ratio respectif du nombre de colloides
moins denses que l'eau (huileux ?) et de colloides plus lourds qui
s'agglutinent près du coagulant soit en jeu. Le phénomène est certainement
complexe puisqu'il met en jeu des particules qui précipitent (Al(OH)3(s) , Fe(OH)3(s) ) et qui sont retenues par un nombre variable de colloides de densité
différente, les forces de Van der Walls et les forces électrostatiques entrant
en jeu. Mollah et al utilisent les
termes «surface complexation» et forces électrostatiques [18].
Les données de la
littérature montrent que pour qu’un atome de fer « sorte » de la
structure à laquelle il est attaché celui-ci doit perdre deux électrons [29];
le stade initial est donc un ion Fe2+.
Pour un atome d’aluminium cependant il y a perte de trois électrons. Le fer a
une masse de 55.8 g/mole, l’aluminium 27. Donc pour 6 électrons on aura une
masse atomique de 167,4 obtenue pour le fer et une masse atomique de 54 pour
l’aluminium. C’est pratiquement un ratio de 3, ce qui explique qu’avec un
courant moindre on dissous beaucoup plus de fer. Le fait qu’on obtienne un
ratio nb de coulombs/poids perdu de 2 seulement dans le tableau 2 de la section
5.9 Diminution du poids de l’anodeest relié à la présence de deux lignes du tableau qui
donnent un ratio très élevé pour un pH non neutre avec le fer et d'au moins une
donnée suspecte pour l’aluminium (le ratio de 111.45), ce qui fausse la
moyenne. Dans les faits la majorité des données pour l'aluminium donnent un
ratio ampères-minute/perte de poids de presque 155-160 pour l'aluminium et de
52 pour le fer.
7.2 Influence du pH
7.2.1
Effet du pH
initial sur l'efficacité de la coagulation
Une des différences qui
existent entre le processus d'électrocoagulation et le traitement
physico-chimique concerne l'impact du pH. L'emploi de sels ferriques et ferreux
donne souvent de meilleurs resultats à des pH élevés comme 10 ou 11. On
explique ce phénomène par la réaction du fer avec les nombreux ions OH-, ce qui
permet la formations de Fe(OH)3(s) ou Fe(OH)2(s) insolubles qui servent de coagulants[26 p 73]. Ainsi le sulfate de fer(II) n'est pas supposé donner un floc d'hydroxyde de fer
pour des pH inférieurs à 8.5 [26, p71] et il est même préférable que celui-ci
soit supérieur à 9. Le chlorure de fer[III] et le
sulfate de fer[III] peuvent par contre réagir à des pH plus acides, mais encore
là on préfère les utiliser à des pH plus élevés; ainsi a-t-on 0.75 ppm de CaCO3
qui réagit avec 1 ppm de sulfate de fer pour donner le floc voulu [26 p 72]. Il en va de même pour le chlorure
ferrique. L'équation pour le chlorure ferrique par exemple serait:
FeCl3+3H2O-->Fe(OH)3(s) +3HCl.
On voit qu'il y a
diminution du pH, donc des ions hydroxides disponibles.
Pourtant les expériences
faites au CEGEP montraient une dégradation légère de la performance (DCO) avec
une anode d'acier et un pH de départ de 10.5 environ. De sucroit une bonne
partie du floc semblait refuser de décanter après l'ajout du polymère. Le
contenu du bécher fut alors divisé dans deux béchers et de l'acide (HCL) fut
ajouté à l'un des béchers. Il y eut d'avantage de décantation dans le bécher
ramené à pH 7 et pratiquement pas dans l'autre. Ceci n'est pas un cas isolé.
Une recherche faite parmi quelques articles montre que d'autres ont constaté le
même phénomène. Holt [16] mentionne que le pH optimum, quelle que soit l'anode,
semble être entre 6.5 et 7.5. ˙I. AyhanSengil[19] mentionne que plusieurs produits de
l'hydrolyse de l'eau (Fe(H2O)63+, Fe(H2O)4(OH)2+,
Fe(OH)4- ) ont une tendance à
polymériser pour une gamme de pH entre 3.5 et 7. Les résultats de ses expériences avec un
effluent de lait indiquent que le pH optimal se situe entre 6 et 7 pour une
anode de fer. Le rendement tel qu'il le calcule passe de 98 (pH 6.5) à 94%
environ pour un pH>10. Mentionnant une recherche qu'il a lu, Guohua Chendit par contre qu'avec une anode de fer
l'enlèvement de la couleur et de la DCO est favorisée à pH plus basique pour
des effluent contenant des teintures utilisés dans les textiles[23]. Il ne dit
pas si l'augmentation de la conductivité de la solution à un pH non neutre a
été pris en considération pour établir une métrique
valable. Arslan-Alaton[15]
dit que le procédé est légèrement plus efficace pour un pH de 7.5 (plutôt que
9.5 ou 5.5).
Même si je n'ai fait que
trois expériences à pH basique il est probable que ce phénomène soit bel et
bien réel. Premièrement le processus d'électrocoagulation et le traitement
physico-chimique ne donnent pas nécessairement les mêmes réactions chimiques.
Comme on le verra plus loin la formation de floc n'est pas seulement le
rassemblement de colloïdes autour d'une molécule d'hydroxyde de fer, il y a
aussi d'autres réactions chimiques qui peuvent se produire avec le fer.
Deuxièmement la formation de Fe(OH)3(s) n'a pas besoin d'un pH alcalin pour être
favorisée. Dans les deux cas il y a
adsorption ou coagulation près du Fe(OH)3(s) , voir même du Fe(OH)2(s)
(pour des pH élevés dans ce dernier cas), mais les sels ferriques ou ferreux
libèrent en solution des ions Cl-, SO43- qui interragissent avec la quantité d'ions OH- disponibles.
Dans le cas de
l'électrocoagulation ce sont des ions de fer pur (Fe2+) qui arrivent en solution et des ions OH- sont
crées pour compenser lors de la formation de H2 à la cathode (dégazage). Il n'y a donc pas de
pénurie de ces ions hydroxides pour assurer une réaction, même à pH 7. Les ions
qui se combinent sont immédiatement remplacés.
Mais ceci n’explique pas
pourquoi le processus semble moins efficace énergétiquement à un pH élevé. On a
vu en effet au tableau 2 (section 5.9) que le ratio nombre de coulombs
nécessaires/quantité de fer dissous monte en flèche avec le pH initial.La
raison pour laquelle le courant est moins efficace à un pH initial de 10.3 plutôt
qu’un pH neutre se trouve probablement dans la solubilité des ions Fe2+. Pour qu’un atome de fer se déleste de deux
électrons, il faut que ceux-ci trouvent un récepteur. Dans le cas d’une
solution neutre les électrons peuvent toujours réagir avec des ions H+ à la cathode et former de l’hydrogène gazeux. La
solution sera alors plus riche en cations Fe2+
(qui sont très solubles à pH neutre) et en ions OH-. A un pH plus élevé les ions H3O+ sont
beaucoup plus rares et la formation d’hydrogène gazeux à la cathode suite à la
rencontre de ceux-ci a moins de chances de se produire. Des électrons passeront
effectivement d’une électrode à l’autre par le biais d’intermédiaires (les ions
en solution) mais si ces électrons ne sont pas utilisés dans un processus
tierce comme la formation d’hydrogène,le pH n’est pas modifié. Donc il ne peut
plus y avoir de nouveaux ions OH-, ce
qui veut dire pas de nouveaux de cations en solution puisque la solution
est électriquement neutre.
Un pH élevé pourrait
aussi entraîner d’autres problèmes. Par exemple si le Fe(OH)3(s) devient
moins présent que d'autres sous-produits du fer à un pH élevé ceci pourrait
nuire à la coagulation. Ceci expliquerait peut-être pourquoi le floc a
précipité plus facilement lorsque j'ai ramené le pH de 10.5 et 12
respectivement à un pH plus neutre.
Un effet positif qu'a un
pH non neutre par contre est de diminuer la quantité de sel qu'on doit ajouter
pour augmenter la conductivité de la solution. Néanmoins il semble y avoir plus
de désavantages qu’autre chose.
7.2.2
Effet de
l'électrocoagulation sur le pH
Toutes les expériences
menées au CEGEP montrent que le pH demeure à peu près neutre lorsqu'une anode
d'aluminium est utilisée alors qu'il
monte avec une anode d'acier. Le pH est même passé de 10.3 à plus de 12 dans un
cas. Ceci n'a rien de surprenant. La libération d'ions Fe2+ laisse deux électrons libres qui peuvent se
combiner avec de l'hydrogène à la cathode pour permettre un dégazage. Tant et
aussi longtemps que ces ions demeurent en solution sans précipiter il y a un
accroissement d'ions OH-. Il faut que d’autres ions Fe2+ soient générés pour qu'un ion Fe(OH)3(s) puisse précipiter. La réaction globale pourrait ainsi
s’écrire:
2Fe(s) ->
2Fe2+ + 4e-
Fe2+
-> Fe3+ + e-
Fe3+
+ 3e- + 3H2O
->Fe(OH)3(s)+1.5H2
2H2O + 2e-
-> H2 + 2OH-
A la fin de la réaction
il y a un cation Fe2+en solution et 2 ions OH-de plus.
Dans le cas de
l'aluminium il y a équilibre. La dissolution d'un atome d'aluminium libère un
cation trivalent mais aussi trois électrons. On a la
réaction:
Al(s) -> Al3+ + 3e-
3 H2O + 3e- -> 1.5 H2 + 3OH-
Al3+ + 3OH-
-> Al(OH)3(s)
On voit donc pourquoi le
pH ne variait à peu près pas avec une électrode d’aluminium. Certains auteurs
ont cependant constaté un accroissement du pH si la solution de départ était acide. Dans le cas de l’aluminium
il est probable que le dégazage d’hydrogène provoque un effet de
« stripping » qui aide au dégazage du CO2. Comme la solubilité du CO2 décroît lorsqu’on passe
d’un pH acide à un pH neutre ceci expliquerait pourquoi le retrait de l’anode
ne provoque pas une re-solubilisation du CO2
et un retour au pH initial[30].
7.3 Électrocoagulation et formation de floc
S'il faut décerner un
prix à la référence sur laquelle je suis tombé et qui explique le mieux les
phénomènes impliqués, celle d'Hector Moreno et
al remporterait la palme. Les auteurs s'interrogent sur le fait qu'une
cellule d'électrocoagulation puisse donner des résultats aussi disparates
concernant l'enlèvement de la DCO. Dépendamment de la molécule à extraire,
l'efficacité varie de 0 à 100%. Leurs expériences menées à partir d'une cellule
Kaselco sont alors utilisées en comparant avec un diagramme de Pourbaix.
Pour un pH inférieur à 5
il n'y a pas de précipitation mais on a du Fe(OH)2(aq) et Fe(OH)3(aq) .
Pour un pH compris entre
5 et 7 on commence à avoir un floc jaune Fe(OH)3(s) ainsi que la formation de rouille 2H2O+2Fe(OH)3<--->
Fe2O3(H2O)6.
Pour un pH compris entre
6 et 8 il y a aussi formation de Fe(OH)2(s), ce qui donne une couleur verte. Il y a également
génération de Fe2O3, de FeO et de Fe3O4 et
polymérisation des oxyhydroxides qui forment un floc.
Pour un pH supérieur à 8 il y a aussi
hydrolise, attaque du fer par l'eau Fe+6H2O-->Fe(H2O)3(OH)3aq
+1/H2
Des substances ont été testées séparément dans la cellule
d’électrocoagulation et le fer résiduel dans la solution a ensuite été testé.
Certains de ces produits sont connus pour leur réaction avec les ions de fer en
temps normal. Le tableau 3 de la page suivante donne un sommaire des résultats.
Les produits
(généralement acides) qui réagissent avec le Fe(II) et
le Fe(III) pour former des produits solubles demeurent en solution. Ceci peut
être déduit à partir de l'accroissement de pH et la concentration finale de
fer.
L’EDTA séquestre les ions
Fe2+ mais préfère les ions Fe3+ lorsque ceux-ci sont disponibles. Même s’il y a
largage d’ions H+, le pH de la solution va
quand même s’accroître dans une moindre mesure tant et aussi longtemps que la
production de cations excède le taux de séquestration. L’ion Fe2+ peut réagir ultérieurement avec de l’oxygène et
perdre un électron, ce qui explique probablement l’augmentation de la DCO [31].
Les
produits solubles ou miscibles qui ne réagissent pas avec le fer ne sont que
faiblement enlevés par coagulation avec les hydroxydes de fer. L’oxalate de sodium est un cas à part pour lequel
Moreno émet une hypothèse non expliquée ici. Les composés solubles qui peuvent
réagir au moins avec le Fe2+ pour former un composé insoluble seront partiellement enlevés et on verra une chute
de la DCO. Les composés solubles qui réagissent avec le fer pour donner un
produit insoluble seront évidemment enlevés. Les huiles, les graisses, le lait
ne sont pas un problème avec l’électrocoagulation à cause de la génération de
coagulant. La fraction qui reste est celle comprenant des composés solubles qui
ne réagissent pas avec le Fe(II) et Fe(III) pour
donner un produit insoluble.
Tableau 3 : expériences de Moreno [2]
|
Substance |
Dans l'eau |
réagit avec le Fe(II)? |
réagit avec le Fe(III)? |
% d'enlèvement de la DCO |
concentration finale en Fe (ppm) |
pH initial |
pH final |
|
EDTA |
soluble |
pour
former un composé soluble |
pour
former un composé soluble |
-58.5
à -87.5 |
52,85 |
2,96 |
10,24 |
|
Acide
acétique |
Soluble |
pour
former un composé soluble |
pour
former un composé soluble |
-3.4
à 0.8 |
563 |
3,01 |
7,64 |
|
Glucose |
Soluble |
non |
Non |
-3.2
à 2.7 |
|
|
|
|
Lactose |
Soluble |
non |
Non |
1.3
à 2.9 |
|
|
|
|
Phénol |
Miscible |
non |
Non |
2.8 |
|
|
|
|
IPA |
Miscible |
non |
Non |
2.7
à 4.4 |
0,069 |
4,5 |
10,98 |
|
Sucre |
Soluble |
non |
Non |
3.6
à 9.6 |
0,178 |
4,59 |
11,19 |
|
Oxalate
de sodium |
Soluble |
* |
* |
11.8
à 19.3 |
0,045 |
5,98 |
11,6 |
|
Acide
citrique |
Soluble |
pour former un composé insoluble |
pour
former un composé soluble |
51.9
à 52.8 |
|
|
|
|
acide
salicylique |
Soluble |
pour former un composé insoluble |
pour
former un composé soluble |
61.8
à 62.8 |
|
|
|
|
acide
tartarique |
Soluble |
pour former un composé insoluble |
se
décompose dans l'eau |
86.7
à 86.9 |
|
|
|
|
acide
oxalique |
Soluble |
pour former un composé insoluble |
pour
former un composé soluble |
87.3
à 87.7 |
76,6 |
2,07 |
7,12 |
|
lait |
suspension |
non |
Non |
73.7
à 74.5 |
0,029 |
5,72 |
10,92 |
7.4 Ampérage vs temps
L'une des
expériences menées au CEGEP (expérience 3) montrait un accroissement inattendu
de l'efficacité énergétique par rapport à l'expérience 4. En augmentant
l'ampérage et en réduisant le temps alloué pour l'électrocoagulation afin
d'obtenir le même nombre de coulombs on se seraient attendus à une perte
d'efficacité puisqu'il y a dissipation inutile d'énergie. Pourtant c'est le
contraire qui s'est produit. Une possibilité est qu'il s'agisse d'une erreur
expérimentale puisque le temps a manqué pour refaire l'expérience. Il était
question à ce moment de chauffer un échantillon identique avec une plaque et
faire passer un courant équivalent à celui de l'expérience 4 (le courant le
plus faible). En effet l'utilisation d'un ampérage élevé provoquait au moins un
effet palpable, le bocal était beaucoup plus chaud. S'il y a augmentation de
l'efficacité énergétique avec une chaleur plus élevée la solution ne serait
pas, dans une installation réelle, d'augmenter l'ampérage démesurément mais
plutôt d'isoler thermiquement le bassin pour conserver la chaleur accumulée par
un courant plus faible. Cette expérience n'a pas été faite.
Néanmoins Chen
mentionne un article très ancien publié dans l'ancienne URSS qui fait référence
à un constat; le rendement semble s'améliorer lorsque la température augmente
jusqu'à un plafond de 60 degrés C [23, p. 19]. Les chercheurs soviétiques
attribuaient cette augmentation de l'efficacité du courant à la destruction du
film d'oxyde d'aluminium sur l'anode. Lorsque la température est trop élevée,
il y a un rétrécissement des pores du Al(OH)3
ce qui donne un floc compact qui est plus susceptible de se déposer sur la
surface des électrodes. La puissance consommée était également plus grande pour
une température plus basse. Il se pourrait donc que l'observation faite au
laboratoire soit la bonne.
Par contre il
n'est pas certain si un phénomène comme celui-ci s'explique par l'hypothèse de
ces chercheurs. Les expériences faites avec le fer sont inutilisables,
curieusement le bocal ne chauffait pas même à un ampérage élevé.
Pour la gamme de courants (0.6 à 2.4 ampères) et voltages (12 à 15 V)
utilisés, les données ne semblaient pas montrer une perte d’efficacité. En mode
bipolaire, la tension totale peut être divisée par N-1 ou N est le nombre de
plaques afin d’avoir le voltage entre chaque plaque. Idéalement on doit éviter
l’électrolyse de l’eau (ampérage élevé), les pertes de chaleur, une dissolution
trop rapide de l’anode qui amènerait un nombre considérable de molécules Fe(OH)3(s) à remonter à la surface sous l’influence des bulles sans même avoir pu
accrocher des colloïdes. Le chemin entre les plaques ne doit pas être trop long
pour minimiser la résistance. Le temps minimal semble de 30 minutes, non
seulement pour les expériences au CEGEP mais aussi au moins une autre
expérience en laboratoire [18].
Le fait que la densité de
courant soit beaucoup plus importante dans mon cas aurait pu avoir un impact
négatif puisque la couche d’oxydation formée rend la dissolution de l’anode
plus difficile. Mais il y a aussi une autre possibilité; les molécules Fe(OH)3(s) ont pu être formées très vite, toujours dans la même
zone, i.e. près d’une anode étroite, et remonter à la surface sans croiser de
colloïdes en nombre suffisant. Le tableau 2 de la section 5.9 montre une perte
approximative de 0.7g de fer pour un abattement d’environ 1800 mg/750mL ou
2,4g/litre de DCO. JAyhanSengil [19] obtient de 0.8 à 1.2g de fer consommé par
kg de DCO enlevée (sa figure 4). Son procédé est 400 fois plus économe en fer
que le mien. Sa densité de courant varie de 0.6 à 1.2 mA par cm2, contre de 37 à 150 mA/cm2 en ce qui me concerne. Le temps de traitement de
Sengil est aussi considérablement réduit (10 minutes ou moins). Une meilleure
agitation mécanique de ma solution n’y changerait pratiquement rien. Ceci peut
être déduit de l’expérience de Ni’am et
F. Othman[18], qui utilisent un courant presque
comparable au mien et une électrode de 26 cm2 (130 x 50 x 4 mm), peut-être même
pas complètement immergée. Leur anode est donc à peine un peu plus grosse que
celle utilisée au CEGEP. Même si ces deux auteurs ne donnent pas la perte de
poids de leur anode, leur temps de traitement est visiblement du même ordre que
le mien.
8
Design final
et analyse de coûts
Modifications
au design
Avant de faire une estimation sommaire des
coûts il convient de revoir le design suggéré dans la section 6. Si on se fie
uniquement aux résultats obtenus au laboratoire du CEGEP, un temps de 30
minutes serait nécessaire mais en réduisant la densité de courant, soit en
augmentant la superficie des plaques, il n’est pas audacieux d’affirmer qu’un
temps de 20 minutes serait suffisant. Donc pour traiter 2,000 m3
par jour une cellule devrait faire 55 m3 si on suppose
12h de fonctionnement par jour, 70 ou 75 m3 avec un
facteur de sécurité. On veut idéalement un ratio surface/volume de 30 m2/m3
(voir section 6.3) soit 2250 m2de plaques.
Un critère de conception retenu pour faire mes calculs concerne le poids
des plaques d’acier. Pour des raisons pratiques celles-ci doivent pouvoir être
déplacées aisément par deux hommes tout au plus. La masse volumique de l’acier
(oxydable) est de 7850 kg/m3, donc si on limite
le poids à 100 kg par plaque on a un volume maximal de 0.0127 m3 par plaque. Pour une épaisseur de 1 cm ceci donnerait une surface de
1.27 m2, le double pour une
épaisseur de 0.5 cm. En supposant une hauteur de 1.5m des plaques ceci laisse
1.7m de large pour 0.5 cm d’épaisseur. Une distance de 3 cm entre les plaques
se rapprocherait non seulement de mes données expérimentales mais aussi de
celles d’AyhanSengil. Soit N, le nombre de plaques par bassin, et S, la surface
totale de celles-ci on a donc
[équation 1]: (N-1)
x 1.5m x 1.7m=S
[équation 2]: 30 m2/m3= (N-1) x 1.5m
x 1.7m x L
oùL est la longueur du bassin. Mais ici L est égal à (N-1) x 3.5 cm si on compte l’épaisseur de la plaque en plus de la distance entre deux plaques.
Sengil [19] divise son voltage (15V au maximum) sur ses quatre plaques
en mode bipolaire, ce qui donne 5 volts au maximum entre chaque plaque. Il ne
mentionne pas, pour sa densité de courant
optimum (0.6 mA/cm2) quel est le voltage appliqué mais le fait qu’il
donne une gamme de 0.3 à 1.8 mA/cm2 pour les tests
effectués avec une batterie fournissant jusqu’à 15 V DC laisse croire que c’est
5 ou 6 volts. Par contre c’est le seul auteur qui amène un optimum aussi bas,
son 6 A/m2 est même plus bas que la
fourchette 10-150 A/m2 donnée par Holt
[16]. Il ne fait aucun sens d’utiliser mon rendement au laboratoire vu les
électrodes de fortune employées, par contre il est aussi plus prudent de
supposer que la dépense énergétique soit donnée par 1.8 mA/cm2 pour 5 volts entre chaque
plaque. Il est toujours possible de réduire la tension le cas échéant.
Si on veut maintenir une différence de potentiel réaliste de 150 volts
tout au plus entre les deux bornes ceci donne 31 plaques (il y a donc 30
distances inter plaque de 3 cm donnant un maximum de 5 volt) ce qui donne une
longueur du bassin de 30 x (0.03m+0.005m) =1.05m, une surface totale des
plaques de 76.5 m2 par bassin, un volume de
2.68 m3 par bassin et un ratio
Surface de plaques/Volume de 28.57, ce qui est très proche du ratio de 30 visé.
Pour un volume de 75 m3 il faudrait donc 28 bassins de ce type,
probablement moins dans les faits. Vu la dimension de chaque bassin on voit
qu’un système utilisant un racloir pour ramasser le floc au fond est
irréaliste. Il faudra simplement s’assurer que le fond d’un bassin soit
rapidement séparable des parois pour un nettoyage rapide lors des opérations de
maintenance. Le système de récupération de l’écume tel que proposé dans la
section 6.2 n’est pas non plus viable dans sa forme initiale. Celui-ci impliquait
la récupération d’une écume (via les goulottes) comportant trop d’eau ainsi
qu’un filtrat qui pourrait encore contenir de la mousse et l’injection d’air comprimé à une faible profondeur dans un petit bassin pour
palier à ces problèmes.
On ne peut pas utiliser
un système de tuyaux et d’orifices sous la mousse pour récolter l’eau traitée,
celle-ci sera chargée de flocs de toute façon. La façon la plus simple est de
récolter l’eau qui se déverse latéralement d’un côté du bassin (une des parois
serait plus basse que l’autre), acheminer celle-ci par une gouttière vers un
bassin central qui traiterait les effluents d’un groupe de petits bassins. Le
schéma de la page suivante illustre le système. Comme l’eau qui arrive dans ce
bassin (paroi « A ») est un mélange de floc décantable et de floc
flottant en surface, la paroi opposée (« B ») comporterait en fait
une goulotte qui récolte l’écume en surface. Quelques centimètres sous
celle-ci, l’eau épurée est récoltée par des tuyaux. Une solution de polymère
est injectée sous la surface de l’eau qui arrive en « A » et une
hélice assure une agitation minimale. L’écume récupérée en B peut être
retraitée dans un bassin peu profond « C » où il y a injection d’air.
Près du fond de ce petit bassin un tuyau permet de récolter l’eau appauvrie en
floc et de la ramener vers le bassin principal.
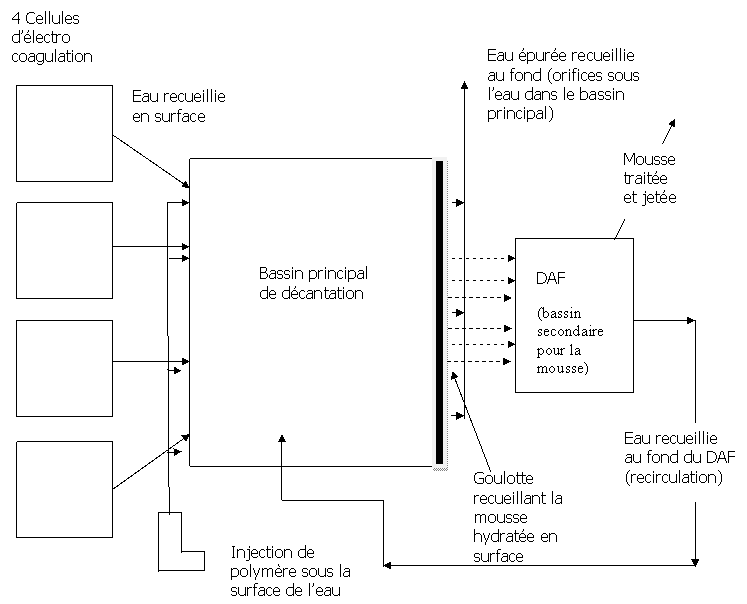
Ce système comporte une
complexité supplémentaire vu la présence de floc flottant et de floc qui
décante. Une alternative serait de sacrifier le module DAF et de ne viser que
de la décantation dans le bassin principal (le bassin de collection). Les flocs
qui restent en surface sont portés par des micro bulles
d’hydrogène qui se sont logés sous ceux-ci. Il faudrait donc non seulement les
plonger sous l’eau mais aussi les retourner pour que l’hydrogène s’échappe.
Cependant une agitation vigoureuse latérale amènera autant de bulles qu’elle
n’en fera sortir. Le but est de pousser les flocs vers le fond tout en les retournant
de 90 ou 180 degrés. Une possibilité serait l’implantation d’un ou plusieurs
rotors de ce genre au début du bassin de collection.

La vitesse de rotation serait
plutôt lente. Bien sûr, des flocs présents quelques centimètres sous l’eau
seraient aussi amenés en surface mais comme leur concentration est déjà
beaucoup plus grande en surface du côté gauche il y a un gain net.
Coûts
Comme on l’a vu dans la section précédente une densité de courant de 1.8
mA/cm2 soit 18 A/m2 est réaliste. Donc on aurait 18
A/m2 x 1.5m x 1.7 m x ( 5 volts x 30 distances inter plaques ) = 6885 Watts par
bassin soit, pour 20 basins fonctionnant simultanément, 137 kW, 12 heures par
jour. Bien entendu il y a aussi consommation de puissance par le transformateur
et la puissance pourrait monter facilement à 180 kW.
Pour une entreprise, le
tarif G (moins de 100 kW) ne semble pas avantageux vu
les nombreux dépassements prévus. Par exemple le prix monte en flèche lorsque
la consommation dépasse 50 kW. Le tarif M semble préférable, il s'applique à l'abonnement d'un
client dont la puissance maximale a été supérieure à 50 kW durant au moins
une des douze périodes mensuelles de facturation précédentes [32]. Celui-ci
donne 13.44$ par kW (par mois) et 4.46 cents par kWh pour les 210,000 premiers
kWh, 3.19 cents/kWh ensuite. On a pour notre cas hypothétique 12h x 180 kW soit
2160 kWh par jour ou 64,800 kWh par mois.
Donc on aurait 13.44$/kW x 180 kW +64,800kWh x 0.0446$ =5309.30$ par
mois. A ceci il faudrait ajouter le coût en électricité d’un système d’air
comprimé (injection de bulles) pour le bassin secondaire. Si on ajuste le
niveau de la goulotte et la géométrie du bassin principal pour que 10% des 2000
m3/jour soient récoltés par le
bassin secondaire (DAF), qu’on considère que celui-ci a une profondeur peu
importante (10 cm), il devient possible de faire une évaluation. Celle-ci ne
sera pas faite dans ce travail cependant.
Coût des anodes
Le prix de l’aluminium tourne autour de 2700$ la tonne [33] , celui de l’acier non inoxydable 750$ la tonne [34].Sengil
[19] donnait une perte de 1.2g de métal pour traiter 1 kg de DCO avec 1.8 mA/cm2. Avec son bassin de 650 mL et une charge de 18,000 mg/L enlevée ceci
implique que la perte en poids de ses anodes était de (0,018g x 0.65L x
1.2g/kg) = 0.014 gramme. Sengil donne par contre son rendement par kg de DCO
enlevé mais ceci ne fait aucun sens puisque quelle que soit la charge initiale
c’est la dissolution du fer et la formation de Fe(OH)3 qui consomme l’anode. Donc même avec un effluent moins chargé la
consommation serait la même. Avec 2,000 m3 par jour on aurait
donc (2,000,000/0.65L) L x 0.014g=43000g ou 43 kg.
En supposant que les plaques sont retirées bien avant leur dissolution
totale, disons lorsque leur épaisseur n’est plus que de 1 mm au lieu de 5mm, il
faudrait un mois pour consommer 1300 kg d’acier.
Le prix donné sur le site mentionné plus tôt (750$ la tonne) l’est pour des plaques finies qui n’ont
probablement pas les bonnes dimensions. Le coût de la livraison n’est pas
inclus. En se gardant un facteur de sécurité de 2 on en arrive à 1300 kg x
1.5$/kg x 2 =3900$ aux 30 jours lorsque les plaques sont remplacées.
Le coût de l’électricité est donc environ 1.5 fois plus important que le
coût des matériaux. Il existe une foule d’autres coûts, le polymère (1g/m3 d’eau ou 2 kg par jour), les pompes, la tuyauterie, l’entretien, la
machinerie pour retirer les plaques, les bacs d’acide pour les nettoyer,
l’acide pour neutraliser le pH trop basique à la sortie du traitement, la base
ou l’acide pour obtenir un pH neutre à l’entrée du traitement, mais comme cette
section se donnait comme objectif de cerner uniquement certains coûts l’étude
s’arrête ici.
9
Conclusion
L’électrocoagulation d’un
affluent de lait permet d’obtenir un rendement tout à fait acceptable lorsqu’on
parle d’enlèvement du phosphore, de l’ammoniac, de la turbidité et la couleur
mais le pourcentage d’enlèvement plafonne souvent à 70%, non seulement lors de
mes expériences mais aussi pour plusieurs expériences menées en laboratoire par
des chercheurs. Il n’y a que Sengil qui fait bande à part et qui affirme avoir
obtenu un enlèvement de 98% pour un affluent très chargé. Celui pourrait bien
n’avoir contenu que peu de lactose. Moreno, entre autres, a identifié le
lactose comme un composant qui est pratiquement insensible à
l’électrocoagulation. Le temps alloué pour ce projet n’a pas permis de trouver
une méthode abordable et réaliste pour l’enlèvement du surplus de DCO provoqué
par la présence de lactose et de divers sucres. Il existe cependant quelques
pistes intéressantes.
Une compagnie qui produit
une quantité importante de rejets peut souvent se payer le luxe d’un RBS et
trouver les techniciens qualifiés nécessaires au maintien d’un système sophistiqué.
Néanmoins l’électrocoagulation peut aussi s’insérer dans la chaîne de
traitement pour l’enlèvement du phosphore uniquement. Les calculs faits dans ce
projet concernaient implicitement l’enlèvement de celui-ci ; en effet la
densité de courant optimale pour éviter une perte par flottation prématurée des
molécules Fe(OH)3 serait la même, ce qui changerait serait la charge
polluante à enlever, donc le débit possible. Le nombre nécessaire de cellules
d’électrocoagulation serait nécessairement moindre. Par contre l’aspect du floc
et son comportement pourraient différer si l’huile a déjà été enlevée dans une
étape antérieure.
Un design a été proposé
mais il ne s’agit en fait que d’une ébauche. Un des problèmes constatés par Holt[16] est l'absence de modèle mathématique précis qui
donne des prédictions viables sur le comportement du procédé. On peut faire un
design à partir d'un prototype pour un effluent donné, mais il n'y a pas de
design dominant qui a supplanté les autres. L'amélioration d'une caractéristique
peut se faire au détriment d'une autre et le tout doit être déterminé
empiriquement. Le fait que la densité optimale varie autant selon l’affluent
traité en dit long là-dessus. Il y a probablement beaucoup plus à faire
concernant le développement d'un système performant et applicable sur une gamme
importante d'effluents (un problème de génie chimique).
10
Bibliographie
[1] Treatment of dairy effluents by electrocoagulation
using aluminium electrodes.Tchamango S, Nanseu-Njiki
CP, Ngameni E, Hadjiev D, Darchen A.
http://www.ncbi.nlm.nih.gov/pubmed/19900696
[2]ELECTROCOAGULATION: COD REMOVAL MECHANISM, Hector A. Moreno, David
L. Cocke, Jewel J. A. Gomes, Lamar University,
Beaumont; TX, Paul
Morkovsky, Kaselco
Co., Shinner TX, J. R. Parga,
Tecnologico de Saltillo, Saltillo, Coah., Mexico.
http://www.nt.ntnu.no/users/skoge/prost/proceedings/aiche-2006/data/papers/P68682.pdf
[3]
http://www.rpi.edu/dept/chem-eng/Biotech-Environ/IMMOB/lactose.html
[4]
http://www.milkfacts.info/Nutrition%20Facts/Nutritional%20Components.htm
COD 61% http://www.ncbi.nlm.nih.gov/pubmed/19900696
phosphore 89%
http://www.ncbi.nlm.nih.gov/pubmed/19900696
azote 81% http://www.ncbi.nlm.nih.gov/pubmed/19900696
aussi : http://www.ncbi.nlm.nih.gov/pubmed/19900696 disent que lactose reste
[5] Dairy chemistry and biochemistry,P. F. Fox,
P. L. H. McSweeney
http://books.google.ca/books?id=6Q8mX8DsDe4C&pg=PA54&lpg=PA54&dq=lactose++reaction+oh-&source=bl&ots=kxFLgSF5w5&sig=VrX1nkp6avUvH886hqwrB3rbc-0&hl=en&ei=VWO8TbLrDdDdgQet1IXrBg&sa=X&oi=book_result&ct=result&resnum=9&ved=0CD4Q6AEwCA#v=onepage&q=lactose%20%20reaction%20oh-&f=false
[6]
http://www.lactose.com/basic/chemical_properties.html
[7] Separation of lactose from milk by ultrafiltration,PongsathonLimsawat
and SuwattanaPruksasri*
http://www.ajofai.info/Abstract/Separation%20of%20lactose%20from%20milk%20by%20ultrafiltration.pdf
nanofiltration requise:
http://www.geafiltration.com/applications/milk_applications.asp
[8] “There is no report, however, on
the identification of the degradation products of lactose by ionizing
radiation. […]”
http://www.google.ca/#hl=en&biw=966&bih=476&q=ionizing+lactose&aq=f&aqi=&aql=&oq=&fp=31c458f914b08b25
[9] Lactose Recovery with Magnesium, Soon-Young Kwon, Richard A. Behrnard, J Dairy
Science 64:396-406, 1981http://download.journals.elsevierhealth.com/pdfs/journals/0022-0302/PIIS0022030281825854.pdf
[10]http://www.ilri.org/InfoServ/Webpub/fulldocs/ilca_manual4/Milkchemistry.htm
[12] Recovery of lactose from aqueous solutions: precipitation with calcium
hydroxide and sodium hydroxide.
McCommins, D. B.; Bernhard,
R. A.; Nickerson, T. A.
Journal of Food Science 1980 Vol. 45 No. 2 pp. 362-366
http://www.cabdirect.org/abstracts/19800457748.html;jsessionid=5C171EE934A702CAC81D0A45083FAA16
aussi:
RECOVERY OF LACTOSE FROM AQUEOUS SOLUTIONS: PRECIPITATION IN THE PRESENCE
OF CALCIUM HYDROXIDE AND AMMONIUM CHLORIDE ADDITIONS
AGUSTIN OLANO,†,
T. A. NICKERSON, R. A. BERNHARD
http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2621.1977.tb08404.x/abstract
http://nzic.org.nz/ChemProcesses/food/6E.pdf
[13] http://www.tutorvista.com/content/chemistry/chemistry-iv/surface-chemistry/flocculation.php
[14] Biological Purification of Creamery Wastes, Max Levine
Sewage Works Journal, http://www.jstor.org/pss/25028151
[15] Effect of Operating Parameters on the Electrocoagulation of Simulated
Acid Dyebath Effluent,
The Open Environnemental&
Biological Monitoring Journal
Arslan-Alaton, I.Kabdash
and Y. Sahin
www.benthamscience.com/open/toebmj/articles/V001/1TOEBMJ.pdf
[16] ELECTROCOAGULATION AS A WASTEWATER TREATMENT
Peter Holt, Geoffrey Barton and
Cynthia Mitchell
The Third Annual Australian Environmental Engineering Research Event.23-26
November
http://www.isf.uts.edu.au/publications/PH_GP_CM_1999.pdf
[17] ETUDE DE L'EPURATION PAR
ELECTROCOAGULATION DES REJETS LIQUIDES D'UNE INDUSTRIE DE TRAITEMENT DE SURFACE
A CASABLANCA
Brahim LEKHLIF1, Fatiha ZIDANE2, Loubna OUDRHIRI 2,Patrick DROIGUI3, Je
[18]Electrocoagulation technique in enhancing COD and suspended solids
removal to improve wastewater quality
M.F. Ni’am*,
F. Othman** , J. Sohaili**
and Z. Fauzia**
http://eprints.utm.my/8468/1/8468.pdf
[19]Treatment of dairy wastewaters by electrocoagulation using mild steel
electrodes, I. AyhanSengil a,*, Mahmut ¨ozacar b
Journal of Hazardous Materials B137 (2006) 1197–1205
http://www.asengil.sakarya.edu.tr/mak13.pdf
[20] Traitement des rejets
industriels liquide par électrocoagulation/électroflotation en réacteur airlift,
Mounir BENNAJAH
http://ethesis.inp-toulouse.fr/archive/00000708/01/bennajah.pdf
[21]Treatment of simulated dairy wastewater by electrocoagulation,(abstract)
MansoorJehangir
http://gradworks.umi.com/14/41/1441235.html
[23]Electrochemical technologies in wastewater treatment
Guohua Chen
Separation and Purification Technology 38 (2004) 11–41
infolib.hua.edu.vn/Fulltext/ChuyenDe2009/CD140/38.pdf
[24]Pilot-Scale Electrocoagulation with Bipolar Aluminum Electrodes for
On-Site Domestic Greywater Reuse
Chin-Jung Lin1; Shang-Lien Lo2;
Chao-Yin Kuo3; and Chung-Hsin Wu4
ntur.lib.ntu.edu.tw/bitstream/246246/96832/1/57.pdf
[25]CNIDEP Centre National
d'Innovation pour le Dévellopement Durable
http://www.cnidep.com/electrocoagulation157.html
[26]Techniques et contrôle des eaux, http://whqlibdoc.who.int/monograph/WHO_MONO_49_(chp5)_fre.pdf
[27]
Peroxide Interference in the PeCOD®
and Dichromate Methods for COD,
www.aquadiagnostic.com/downloads/.../peroxide_interference_in_cod.pdf
[28]
Global kinetics of the
alkaline oxidative degradations of lactose, H.E J. Hendriks ‘, B.F.M. Kuster, G.B.
Marin *, Journal of Molecular Catalysts 93 ( 1994) 317-335
alexandria.tue.nl/repository/freearticles/621166.pdf
[29]http://www.ncbi.nlm.nih.gov/pubmed/19544898
[30] Separation of pollutants from
restaurant wastewater by electrocoagulation, Chen, X, Chen G,
[31] http://www.ncbi.nlm.nih.gov/pubmed/1311166
Spin trapping study on the kinetics of Fe2+
autoxidation: formation of spin adducts and their destruction by superoxide.
[32] http://www.hydroquebec.com/affaires/moyen/tarif-affaires.html
[33] http://www.ems-power.com/ems-metallkurse/ems-metallkurse.fr.shtml
aussi,
par livre : http://www.metalprices.com/
[34] http://www.worldsteelprices.com/ et http://www.meps.co.uk/N.Amer%20Price.htm
[35] http://www.mddep.gouv.qc.ca/eau/eaux-usees/promoteur/guidepromoteur.pdf
[36] http://www.rappel.qc.ca/IMG/pdf/Fiche_technique_3_-_phosphore.pdf
[37] http://www.mddep.gouv.qc.ca/milieu_agri/agricole/faq.htm
[38] http://www.solutions-algues-bleues.com/img/02%20Municipales.pdf page 2
[39] http://passionaqua.free.fr/sections.php?op=viewarticle&artid=6
[41] http://www.mddep.gouv.qc.ca/eau/eaux-usees/LD-prog-autosurveill-effluent-indust.pdf
[42] http://www.mddep.gouv.qc.ca/eau/eaux-usees/NH4_OMAE.pdf. page 9
[43] http://www.mddep.gouv.qc.ca/eau/eaux-usees/NH4_OMAE.pdf section 3.1
[44] http://www.mddep.gouv.qc.ca/eau/eaux-usees/industrielles/chapitre1.htm
[45] http://www.mddep.gouv.qc.ca/eau/eaux-usees/industrielles/chapitre3_d.htm#36_assainiss
[46] http://www.slideshare.net/idealconnaissances/situation-de-lanc-au-qubec
[47] http://www.mddep.gouv.qc.ca/eau/eaux-usees/promoteur/guidepromoteur.pdf tableau 4.1
[48] http://www.mddep.gouv.qc.ca/eau/eaux-usees/promoteur/guidepromoteur.pdf page 25
[49] http://www.mddep.gouv.qc.ca/Industriel/demande/guide-oer-ind-mars08.pdf
[50] Chimie des Eaux, M. Henry, p. 107



